استئوسارکوما و پیوند استخوان آلوگرافت

- نویسنده: Adel Marzban
- آموزش
- 5 (4)
استئوسارکوما (Osteosarcoma) یک سرطان اولیه تهاجمی استخوان است که اغلب نیاز به برداشتن قطعه استخوانی آسیبدیده دارد. در گذشته، تنها راه درمان این بیماری قطع عضو بود، اما پیشرفتها در زمینه شیمیدرمانی (Chemotherapy) و جراحی ترمیمی (Reconstructive Surgery)، جراحیهای حفظ عضو را امکانپذیر کرده است. یکی از اجزای کلیدی در نجات عضو برای بیماران استئوسارکوما، بازسازی با پیوند استخوان آلوگرافت (Allograft Bone) است؛ جایی که یک استخوان اهدایی (آلوگرافت) جایگزین قطعه برداشتهشده میشود. این پیوند آلوگرافت میتواند پیوستگی ساختاری را بازیابی کند و بهعنوان داربستی برای جوشخوردن استخوان خود بیمار عمل کند. این مقاله به بررسی مسیر پیوند آلوگرافت استخوان در درمان استئوسارکوما، از اولین تلاشها برای پیوند تا تکنیکهای نوین، میپردازد و انواع آلوگرافتها (تازه در برابر منجمد، پرتودیده و غیره)، نتایج و آخرین نوآوریها برای جراحان ارتوپدی و انکولوژی را مرور میکند.
نقاط عطف تاریخی در استفاده از پیوند استخوان آلوگرافت
پیوند استخوان سابقه شگفتانگیزی دارد و تلاشهایی در این زمینه قرنها پیش مستند شده است. در ادامه، برخی از نقاط عطف کلیدی در توسعه استفاده از پیوند استخوان آلوگرافت در سراسر جهان آورده شده است:
• ۱۶۶۸ – پیوند زنوگرافت اولیه
یک جراح هلندی به نام “جوب ون میکیرن” به عنوان اولین فردی که پیوند استخوان را ثبت کرد، شناخته میشود. او از یک قطعه از جمجمه سگ برای ترمیم نقص جمجمه یک سرباز استفاده کرد. این پیوند هترولوگ (Heterologous Graft) در نهایت به دلیل مخالفتهای مذهبی باید برداشته میشد، اما مفهوم پیوند استخوان را نشان داد.
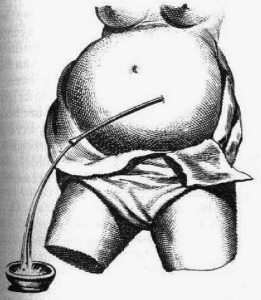
او بسیاری از تجربیات و مشاهدات دقیق خود، از جمله تخصصش در جراحی دست و روشهای تخلیه مایع شکمی را در کتاب تأثیرگذار خود با عنوان “Heel- en Geneeskonstige Aenmerkingen” (مشاهدات پزشکی-جراحی) ثبت کرد. این کتاب که در سال ۱۶۶۸ منتشر شد، به عنوان یک منبع ارزشمند، نمایانگر هنر و دانش پیشرفته جراحی در آمستردام آن دوره است.
• ۱۸۲۰ – اولین پیوند اتوگرافت
یک جراح آلمانی به نام “فیلیپ فون والتر” اولین پیوند استخوان اتولوگ (Autologous Bone Graft) موفقیتآمیز (با استفاده از استخوان خود بیمار) را انجام داد و در دوران پیش از ضدعفونی، پیشگام پیوند استخوان شد.
• ۱۸۷۹ – اولین پیوند آلوگرافت انسانی
یک جراح اسکاتلندی به نام “ویلیام مکایون” اولین پیوند استخوان بین انسانی را انجام داد. او نقص استخوان بازو (humerus) یک پسر ۳ ساله را با یک استخوان اهدایی از بیمار دیگری ترمیم کرد. گزارش مکایون در سال ۱۸۸۱ نشان داد که پیوند با موفقیت جذب شده و بازوی کودک نجات یافته است؛ این یک نقطه عطف در آغاز جراحی آلوگرافت بود.
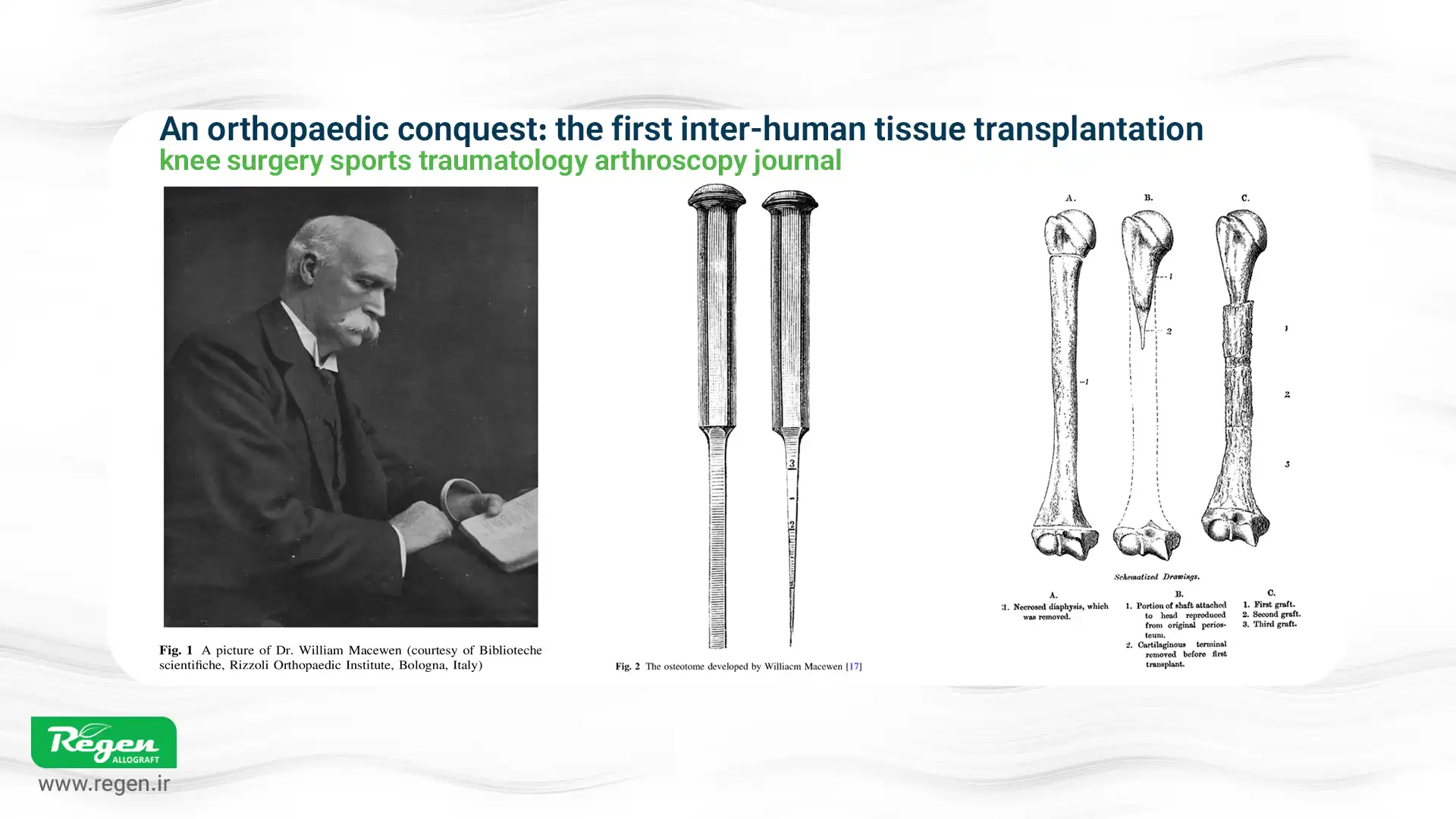
• اوایل دهه ۱۹۰۰ – آزمایشات لکسر
جراح آلمانی، “فریتز لکسر”، مرزها را با پیوند کامل مفاصل و قطعات بزرگ استخوان از جسدها گسترش داد. در سال ۱۹۰۸، او استفاده از “پیوندهای استخوانی آزاد” را گزارش کرد و بعداً در سال ۱۹۲۵، پیوند مفصل را نیز امتحان کرد. با وجود اینکه بسیاری از این آلوگرافتهای بزرگ اولیه به دلیل عفونت یا رد ایمنی (پیش از کشف آنتیبیوتیکها و تعیین نوع بافت) با شکست مواجه شدند، کار لکسر زیربنای تلاشهای ترمیمی آینده را پایهگذاری کرد.
• دهه ۱۹۴۰ – ظهور بانکهای استخوان
در طول و پس از جنگ جهانی دوم، مفهوم بانکهای استخوان برای رفع نیاز به پیوندها پدیدار شد. نیروی دریایی ایالات متحده اولین بانک ملی بافت نیروی دریایی (National Naval Tissue Bank) را در بتسدا تأسیس کرد و بیمارستانها در سراسر جهان بانکهای استخوان کوچک را راهاندازی کردند. استخوان اهدایی از قطع عضو یا جسدها میتوانست به صورت عمیق منجمد و ذخیره شود. کاربردهای اولیه عمدتاً قطعات کوچک برای پر کردن کیستهای استخوانی، کمک به فیوژنهای نخاعی یا درمان عدم جوشخوردگیها (Non-unions) بود. این توسعه عرضه بافت آلوگرافت را تضمین کرد و کاربرد بالینی گستردهتری را به دنبال داشت.
• دهه ۱۹۷۰ – نجات عضو برای تومورها
دوران نوین جراحی نجات عضو آغاز شد. بهبود در شیمیدرمانی (که به طور چشمگیری بقای بیماران استئوسارکوما را افزایش داد) به جراحان این امکان را داد که به جای قطع عضو، بر بازسازی اندام پس از برداشتن تومور تمرکز کنند. در سال ۱۹۷۳، “پاریش” یک سری از ۲۱ بیمار را گزارش کرد که در آنها قطعاتی از استخوانهای بلند که به دلیل تومور برداشته شده بودند، با موفقیت با آلوگرفتهای جسدی حجیم (که برخی شامل سطوح مفصلی بودند) جایگزین شدند. تقریباً همزمان، پیشگامانی مانند “مانکین”، “انکینگ” و دیگران در آمریکا، کانادا و آرژانتین نیز شروع به استفاده از آلوگرافتهای استخوانی-مفصلی (osteoarticular) حجیم برای تومورهای استخوانی کردند. این سریهای اولیه ثابت کردند که بازسازیهای بزرگ با آلوگرافت میتوانند با عملکرد قابل قبول، حفظ عضو را فراهم کنند، اگرچه عوارضی نیز مشاهده شد.
• دهه ۱۹۸۰ – گسترش و جایگزینها
بسیاری از مراکز انکولوژی ارتوپدی (Orthopedic Oncology) در سراسر جهان، آلوگرافتها را برای بازسازی نواقص ناشی از جراحیهای استئوسارکوما، سارکوم اوینگ (Ewing Sarcoma) و تومور سلول غولپیکر (Giant Cell Tumor) پذیرفتند. جراحان همچنین تکنیکهای جایگزین نجات عضو مانند ایمپلنتهای درونپروتزی مدولار (Modular Endoprosthetic Implants) یا مگاپروتزها (Megaprostheses) را بررسی کردند. آلوگرفتها و ایمپلنتهای درونپروتزی به دو گزینه اصلی بازسازی تبدیل شدند که هر کدام مزایا و معایب خود را داشتند. روشهای بانکداری استخوان استانداردتر شدند (انجمن بانکهای بافت آمریکا در سال ۱۹۷۶ تأسیس شد) و همکاری بین جراحان و بانکهای بافت برای تضمین عرضه پیوندهای ایمن افزایش یافت.
• ۱۹۸۰ تا ۲۰۰۰ – تأکید بر ایمنی
با افزایش استفاده از آلوگرافت، انتقال بیماریهای ناگوار نیز رخ داد. به ویژه، چند مورد از انتقال ویروس HIV و هپاتیت از طریق استخوان آلوگرافت در دهه ۱۹۸۰ هشدارها را افزایش داد. تمرکز به سمت ایمنی معطوف شد: غربالگری دقیق اهداکننده، استخراج استریل بهبودیافته و استریلیزاسیون نهایی پیوندها (مانند پرتودهی با پرتو گاما) به یک روال معمول تبدیل شد. در این دوره، مشکل دسترسی به بافت آلوگرافت تا حد زیادی با بانکداری بافت حل شد و ایمنی به مهمترین نگرانی تبدیل شد. مقررات و آزمایشها (مانند آزمایش HIV, HBV, HCV) برای محافظت از بیماران و پردازشکنندگان بافت وضع شد.
• دهه ۲۰۰۰ و پس از آن – بهبود اثربخشی
تا قرن بیست و یکم، با غربالگری بهتر اهداکننده و استریلیزاسیون، خطر عفونت از آلوگرافتها به شدت کاهش یافت. توجه اکنون به اثربخشی و بیولوژی آلوگرفتها معطوف شده است: چگونه به خوبی جذب میشوند، چگونه میتوان قدرت و ترمیم آنها را افزایش داد و چگونه میتوان عوارض را کاهش داد. تحقیقات در سالهای ۲۰۰۰ تا ۲۰۲۰، به بررسی مکملهایی مانند فاکتورهای رشد (Growth Factors)، سلولهای بنیادی (Stem Cells) و روشهای پردازش جدید پرداخته تا بازسازی با آلوگرافت دوامپذیرتر و قابل پیشبینیتر شود. ما این آخرین پیشرفتها را در بخش بعدی بررسی خواهیم کرد.
انواع پیوند استخوان آلوگرافت و روشهای پردازش
همه آلوگرافتها به یک روش آماده نمیشوند. روش نگهداری و استریلیزاسیون میتواند به طور قابل توجهی بر خواص بیولوژیکی و مکانیکی پیوند تأثیر بگذارد. دو دسته کلی که اغلب به آنها اشاره میشود، الوگرفتهای تازه (یا تازه-منجمد) در مقابل آلوگرفتهای منجمد و پرتودیده هستند؛ هر کدام دلایل منطقی خود را دارند:
• آلوگرافتهای تازه-منجمد (بدون پرتودهی)
این پیوندها معمولاً به صورت استریل برداشت میشوند، از نظر وجود عوامل بیماریزا آزمایش شده و بدون استریلیزاسیون نهایی اضافی، منجمد نگهداری میشوند (معمولاً در دمای ۸۰- درجه سانتیگراد). “تازه” در این زمینه به این معنی است که استخوان به صورت شیمیایی درمان یا به شدت پردازش نشده است؛ تنها با انجماد حفظ شده است. طرفداران این روش استدلال میکنند که پیوندهای تازه-منجمد در مقایسه با پیوندهای پرتودیده، قدرت بیومکانیکی و پروتئینهای سلولی زنده (مانند فاکتورهای رشد استخوانی بومی) برتری را حفظ میکنند. در واقع، مطالعات نشان دادهاند که استخوان تازه-منجمد هدایت استخوانی (osteoconductive) بهتری دارد و بازسازی (remodels) بهتری انجام میدهد، زیرا ماتریس کلاژن و پروتئینهای مورفوژنتیک استخوان (BMPs) آسیب کمتری میبینند. نکته منفی این روش، وجود یک خطر بسیار کوچک از عوامل بیماریزای شناسایینشده است، زیرا استریلیزاسیون به غربالگری دقیق اهداکننده و پردازش متکی است و نه به یک مرحله غیرفعالسازی. در عمل، بسیاری از بانکهای استخوان تمام پیوندها را به نوعی استریل میکنند، اما یک پیوند با عنوان “تازه-منجمد” معمولاً به این معنی است که از پرتودهی با دوز بالا یا مواد استریلکننده شیمیایی قوی استفاده نشده است.

• آلوگرافتهای پرتودیده با گاما
پرتودهی گاما رایجترین روش برای استریلیزاسیون نهایی پیوندهای استخوانی آلوگرافت است. پیوندها در معرض اشعه گاما (معمولاً از منبع کبالت-۶۰) با دوز استاندارد حدود ۲۵ کیلوگری قرار میگیرند، که برای از بین بردن باکتریها، ویروسها، قارچها و حتی اسپورها کافی است. این “استریلیزاسیون سرد” به عمق بافت نفوذ کرده و حاشیه امنیتی اضافی در برابر انتقال بیماری فراهم میکند. با این حال، اشعه گاما به ساختار فوقالعاده ظریف پیوند نیز آسیب میرساند: رشتههای کلاژن را شکسته و رادیکالهای آزاد تولید میکند که میتواند استحکام مکانیکی استخوان را کاهش دهد. تحقیقات نشان میدهد که دوزهای پرتودهی بالاتر از حدود ۲۵ تا ۳۰ کیلوگری میتواند به طور قابل توجهی خواص بیومکانیکی استخوان قشری (Cortical Bone) را کاهش دهد (در برابر خستگی ضعیفتر و سختی کمتر). دوزهای بالا یا پرتودهی مکرر میتواند پروتئینهای القاکننده استخوان (osteoinductive) در ماتریس را نیز کاهش داده و جوشخوردگی (integration) را کند کند. بانکهای بافت تلاش کردهاند تا تعادلی پیدا کنند؛ از کمترین دوز مؤثر (حدود ۲۵ کیلوگری) استفاده میکنند و گاهی اوقات برای کاهش آسیب کلاژن، پرتودهی را در شرایط منجمد یا بیهوازی انجام میدهند. با این حال، بحثی مداوم وجود دارد: ایمنی در برابر استحکام. بسیاری از جراحان به دلیل اطمینان از به حداقل رسیدن عفونت، آلوگرافتهای پرتودیده را ترجیح میدهند، در حالی که دیگران برای بیولوژی بهتر، پیوندهای بدون پرتودهی را ترجیح میدهند. بررسی دقیق متون معمولاً از پیوندهای تازه-منجمد از نظر نتایج بالینی حمایت میکند، به شرطی که غربالگری دقیق اهداکننده انجام شود. به عنوان مثال، یک بررسی نتیجه گرفت که استخوان تازه-منجمد جذب و رفتار بیومکانیکی برتری دارد، در حالی که استخوان پرتودیده، با وجود ایمنی بیشتر از نظر عفونی، بیشتر مستعد عوارض دیررس مانند عدم جوشخوردگی (Nonunion) یا شکستگی است.

• آلوگرافتهای خشک-انجمادی (Lyophilized)
علاوه بر آلوگرافت تازه-منجمد در مقابل پرتودیده، برخی از پیوندها (به ویژه قطعات کوچکتر، و نه معمولاً قطعات کامل) به صورت خشک-انجمادی آماده میشوند. خشک-انجمادی (Lyophilization) رطوبت را از بین میبرد و امکان ذخیره پیوندها در دمای اتاق را فراهم میکند. با این حال، خشک-انجمادی میتواند استحکام مکانیکی و القای استخوانی را کاهش دهد. پیوندهای ساختاری خشک-انجمادی به ندرت برای بازسازی استخوانهای تحملکننده وزن استفاده میشوند زیرا شکننده هستند؛ این روش برای پیوندهای خردشده (morselized) یا تراشههای قشری (Cortical Chips) که در روشهای ستون فقرات و دندانپزشکی استفاده میشوند، رایجتر است. برای آلوگرفتهای حجیم در جراحی نجات عضو، انجماد عمیق (با یا بدون پرتودهی) استاندارد است.

• سایر روشهای استریلیزاسیون
از لحاظ تاریخی، تکنیکهای دیگری مانند گاز اتیلن اکسید و استریلکنندههای شیمیایی امتحان شدند، اما ناکارآمدی آنها ثابت شد. برای مثال، اتیلن اکسید، باقیماندههای سمی (مانند اتیلن کلروهیدرین) برجای میگذاشت که بافتها را تحریک میکرد. خیساندن صرف در مواد شیمیایی نمیتواند به طور مطمئن به مرکز استخوانهای بزرگ نفوذ کند. روشهای جدیدتر مانند درمان با دیاکسید کربن فوق بحرانی (Supercritical Carbon Dioxide Treatment) یا گاما با دوز کم همراه با محافظهای رادیویی (Radio-protectants) در حال بررسی هستند تا میکروبها را از بین ببرند و در عین حال کیفیت پیوند را حفظ کنند. پرتودهی با پرتو الکترون (E-beam) نیز روش دیگری است؛ این روش سریعتر از گاما عمل میکند اما نفوذ بافتی کمتری دارد، بنابراین عمدتاً برای پیوندهای نازکتر مفید است. در حال حاضر، پرتودهی گاما با دوز ۲۵ تا ۳۵ کیلوگری یک سازش پذیرفتهشده برای استریلیزاسیون آلوگرافتهای استخوانی بزرگ است و پروتکلها به دنبال به حداقل رساندن معایب آن هستند.
پیوند استخوان آلوگرافت در جراحی استئوسارکوما
استفاده از یک پیوند آلوگرافت برای بازسازی یک نقص استخوانی حجیم (به عنوان مثال، پس از برداشتن یک تومور از استخوان فمور (femur) یا استخوان تیبیا (tibia)) یک تکنیک پیچیده اما ارزشمند است. جراح یک قطعه استخوان جسدی متناسب را که معمولاً از یک بانک استخوان تهیه میشود، به شکلی که جایگزین بخش برداشته شده شود، شکل میدهد. پیوند آلوگرافت با ابزارآلات فلزی (پلاکها، پیچها، و میلههای درونمغزی) در جای خود تثبیت میشود و گاهی با پیوندهای استخوانی کوچک خود بیمار ترکیب میشود تا به بهبودی کمک کند. با گذشت زمان، انتظار میرود که استخوان بیمار با آلوگرافت در محلهای اتصال جوش بخورد و خود آلوگرافت نیز با عروقسازی مجدد از میزبان، به تدریج بازسازی شود. این روش در تضاد با جایگزینی درونپروتزی است، که در آن یک ایمپلنت فلزی جایگزین استخوان و مفصل میشود.
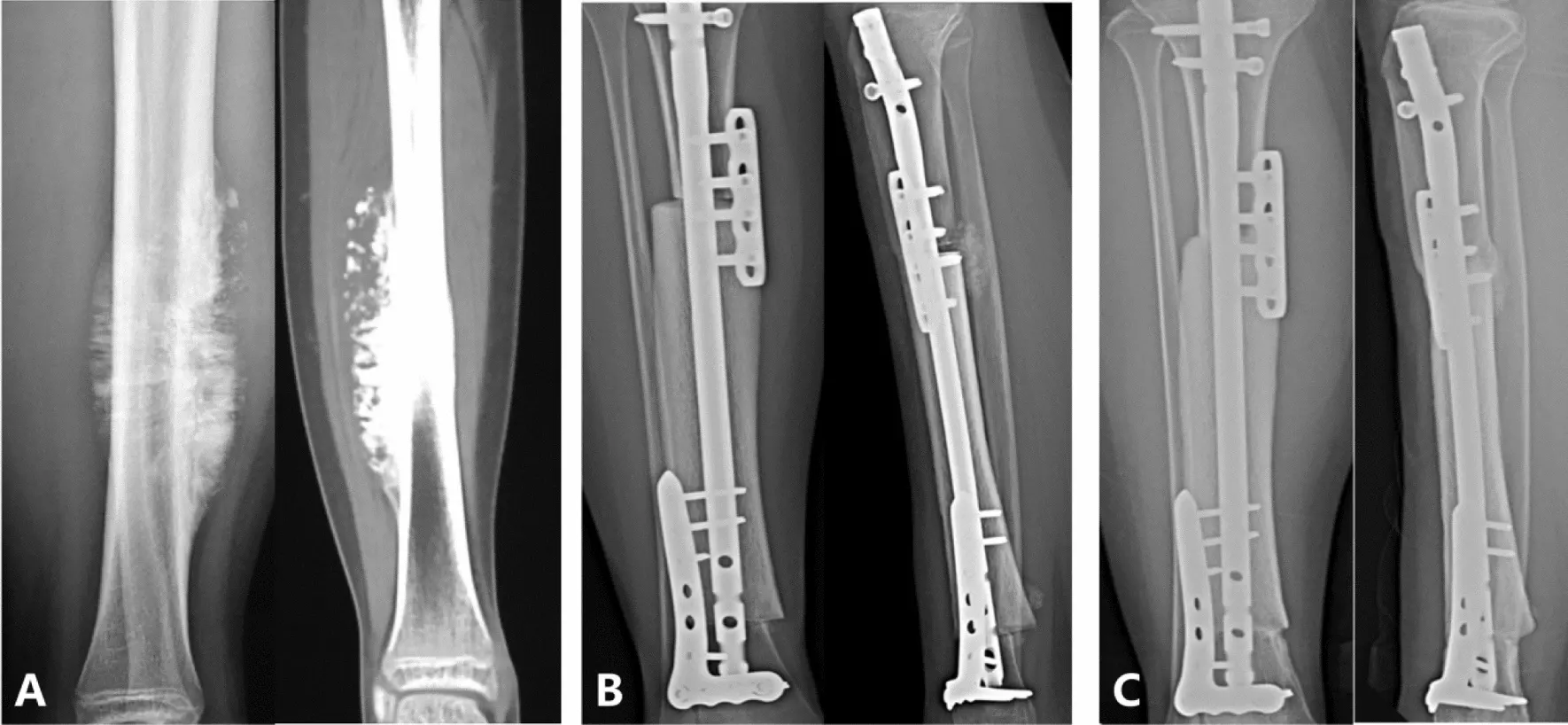
شکل: نمونهای از بازسازی بزرگ استخوان تیبیا (tibia) با آلوگرافت در یک بیمار ۱۴ ساله مبتلا به استئوسارکوما. تصویر منتشر شده از ژورنال “Journal of Orthopaedics and Traumatology”
مزیت اصلی یک پیوند آلوگرافت در نجات عضو
از استئوسارکوما این است که یک بازسازی بیولوژیکی فراهم میکند. پیوند استخوان واقعی است، بنابراین پس از اینکه به استخوان بیمار جوش خورد، به طور بالقوه میتواند دههها دوام بیاورد. آلوگرافتها داربستی برای تشکیل استخوان جدید فراهم میکنند و دارای قدرتی هستند که (در نهایت) امکان تحمل کامل وزن را فراهم میکند. برخلاف یک ایمپلنت فلزی، آلوگرافت خطر فرسایش یا شل شدن به معنای سنتی را ندارد. آلوگرافتها به ویژه برای برداشتن تومورهای حفظکننده مفصل مفید هستند: به عنوان مثال، اگر تنها بخشی از یک استخوان برداشته شود، یک قطعه آلوگرافت متناسب میتواند سطوح مفصلی بومی را حفظ کند، که برای عملکرد بیمار بهتر از جایگزینی کل مفصل است. در بلندمدت، اگر آلوگرافت جوش بخورد، بیمار یک آناتومی “طبیعیتر” را حفظ میکند. آلوگرفتها همچنین به جراحان ترمیمی انعطافپذیری زیادی در شکلدهی یا برش پیوند برای جا افتادن در نقصهای پیچیده (مانند بازسازیهای لگن یا کتف که ممکن است پروتزهای آماده در دسترس نباشند) ارائه میدهند.
چالشها و عوارض استفاده از آلوگرافتهای حجیم
نیز با چالشهای قابل توجهی همراه هستند. آنها فاقد خونرسانی فوری هستند، بنابراین جذب آنها کند است؛ پیوند اساساً مانند یک داربست مرده عمل میکند که بدن باید به تدریج آن را با رگهای خونی و سلولهای استخوانی بازسازی کند. بازسازی کامل (جایگزینی خزنده) یک آلوگرافت قشری بزرگ میتواند سالها طول بکشد. در نتیجه، محلهای اتصال (محلهای جوشخوردگی میزبان-پیوند) اغلب یک نقطه ضعف هستند. عدم جوشخوردگی (Nonunion) (شکست در جوش خوردن انتهای استخوانها) در بخش قابل توجهی از موارد رخ میدهد و اغلب نیاز به پیوند استخوانی اضافی یا جراحیهای ترمیمی دارد. عفونت نگرانی عمده دیگری است: یک آلوگرافت بیحیات سیستم ایمنی ندارد و اگر باکتریها آن را کلونیزه کنند (از جراحی یا جریان خون)، ریشهکن کردن آنها میتواند دشوار باشد. عفونتهای عمیق آلوگرافت میتواند برداشتن پیوند را ضروری کند. شکستگی پیوند آلوگرافت نیز یک عارضه شناختهشده است؛ استخوان پیوندشده، فاقد سلولهای زنده، نمیتواند مانند استخوان طبیعی آسیبهای کوچک را بازسازی کند و ممکن است بشکند، به ویژه اگر به دلیل استریلیزاسیون ضعیف شده باشد یا اگر بهبودی در انتهای آن ضعیف باشد. یک مطالعه جامع ۲۴ ساله بر روی ۸۷۰ آلوگرافت حجیم نشان داد که شایعترین عوارض جدی، عود تومور، عفونت، شکستگی و عدم جوشخوردگی بودند. این عوارض بزرگترین تأثیر منفی را بر موفقیت پیوند داشتند. طبق آن مطالعه، خطر عفونت عمیق حدود ۱۰% در سال اول پس از عمل بود و خطر شکستگی پیوند حدود ۱۹% تا سال سوم به اوج خود رسید. اگر پیوند از آن سالهای اولیه جان سالم به در ببرد، اغلب پایدارتر میشود؛ تقریباً ۷۵% از آلوگرافتهایی که با موفقیت بهبود یافتهاند، حتی پس از ۲۰ سال از جراحی هنوز در جای خود و کارا بودند. این نشان میدهد که اگرچه دوره اولیه پر از ریسک است، نتایج بلندمدت برای بیمارانی که از مرحله بهبودی اولیه عبور میکنند، میتواند بسیار خوب باشد.
مسئله دیگری که به طور خاص مربوط به آلوگرافتهای استخوانی-غضروفی (Osteochondral Allografts) است (پیوندهایی که شامل یک سطح مفصلی هستند، مانند استخوان فمور (femur) دور از زانو) بیماری مفصلی دژنراتیو (Degenerative Joint Disease) است. غضروف پیوندشده برای مدت طولانی زنده نمیماند؛ به دلیل عدم تغذیه (زیرا استخوان پیوندشده در ابتدا عروقسازی نشده تا غضروف را تغذیه کند) دچار تخریب میشود. بسیاری از بیماران با آلوگرفتهای استخوانی-مفصلی با گذشت زمان دچار آرتریت (Arthritis) در مفصل بازسازیشده میشوند. “مانکین” و همکاران گزارش دادند که استئوآرتریت (Osteoarthritis) در آلوگرافتهای استخوانی-مفصلی حدود ۶ سال پس از عمل، به شکل قابل توجهی ظاهر شد و حدود ۱۶% از بیماران با بازسازیهای آلوگرافت زانو یا لگن در نهایت به دلیل تخریب مفصل نیاز به تبدیل به پروتز کامل مفصل داشتند. بنابراین، هنگامی که یک آلوگرافت شامل یک مفصل است، اغلب به عنوان یک راه حل موقت برای حفظ عضو و مقداری عملکرد عمل میکند، با این درک که ممکن است در آینده نیاز به جایگزینی مفصل با یک پروتز باشد.
مقایسه با پروتزهای درونمغزی: برای درک بهتر، نجات عضو با پروتز درونمغزی (ایمپلنتهای فلزی) جایگزینی ساختاری فوری و تحرک زودهنگام را ارائه میدهد، بدون خطر عدم جوشخوردگی بیولوژیکی. با این حال، ایمپلنتها مسائل بلندمدت خود را دارند: مفاصل پروتزی میتوانند شل شوند یا فرسوده شوند و به ویژه در بیماران جوان، یک پروتز ممکن است در طول عمر نیاز به چندین ترمیم داشته باشد. مطالعاتی که آلوگرافت را در مقابل پروتز درونمغزی در نجات عضو مقایسه میکنند، الگوهای شکست متفاوتی را نشان میدهند. آلوگرافتها نرخ عوارض بیولوژیکی بالاتری دارند (عفونت، عدم جوشخوردگی، شکستگی)، در حالی که پروتزهای درونمغزی نرخ شکست مکانیکی بالاتری در طول زمان دارند (شکستگی ایمپلنت، شل شدن). به عنوان مثال، یک مطالعه بلندمدت بر روی بازسازیهای زانو، نرخ شکست ساختاری حدود ۲۰% را در آلوگرافتها در مقابل حدود ۱۰% در پروتزهای درونمغزی مشاهده کرد، اما آلوگرافتها از جراحیهای ترمیمی مکرر که برای ایمپلنتهای شکستخورده لازم است، جلوگیری کردند.
نتایج عملکردی در کوتاهمدت میتواند مشابه باشد، اما یک آلوگرافت ممکن است حس طبیعیتری داشته باشد (زیرا تاندونها میتوانند دوباره به استخوان متصل شوند)، در حالی که یک پروتز درونمغزی بهبودی قابل پیشبینیتر با عوارض اولیه کمتری را فراهم میکند. در عمل، انتخاب اغلب به سن بیمار، محل تومور، پیوندهای در دسترس و تجربه جراح بستگی دارد. بسیاری از مراکز به صورت انتخابی از هر دو روش استفاده میکنند.
نتیجهگیری
از اولین پیوند استخوان در قرن هفدهم تا بازسازیهای پیچیده عضو در امروز، استفاده از پیوند استخوان آلوگرافت راه طولانی را پیموده است. در درمان استئوسارکوما، الوگرفتها جراحیهای نجات عضو را که در دوران قطع عضو خودکار غیرقابل تصور بود، امکانپذیر ساختند. ما دیدیم که چگونه جراحان اولیه مانند “مکایون” و “لکسر” پایه و اساس را بنا نهادند، چگونه بانکداری استخوان پس از جنگ جهانی دوم پیوندها را در دسترس قرار داد و چگونه دهههای ۱۹۷۰ تا ۸۰ الوگرفتها را به عنوان یک گزینه قابل اجرا برای نواقص حجیم تثبیت کردند. در طول این مسیر، جامعه درسهای سختی درباره ایمنی گرفت؛ که منجر به غربالگری دقیق اهداکننده و پذیرش پرتودهی گاما برای حذف تقریباً کامل عفونتها شد. هر دهه بهبودهایی را به همراه داشت: تکنیکهای جراحی بهتر، پردازش دقیقتر پیوند و درمانهای مکمل برای افزایش بهبودی.
امروزه، یک متخصص انکولوژی ارتوپدی ابزارهای متنوعی برای مدیریت تومورهای بزرگ استخوانی دارد: آلوگرافتها، بازیافت اتوگرافت، پروتزهای درونمغزی، یا ترکیبی از اینها. بازسازی حجیم با آلوگرافت یک سنگبنا باقی مانده است، به ویژه برای بیمارانی که به دنبال یک راه حل بیولوژیکی و حفظ مفصل هستند. مطالعات بلندمدت کنونی نشان میدهد که اگر یک آلوگرافت به خوبی بهبود یابد، سهچهارم آنها میتوانند دههها دوام بیاورند و به بیماران یک بازسازی با دوام و عملکرد خوب ارائه دهند. با این حال، عوارض – عفونت، عدم جوشخوردگی، شکستگی و تخریب مفصل – این موفقیت را تعدیل میکند و به ما یادآوری میکند که “تحقیقات باید به سمت بهبود نتایج هدایت شود”، همانطور که “مانکین” تأکید کرد.
آخرین پیشرفتها دقیقاً همین کار را انجام میدهند: ترکیب فاکتورهای رشد و سلولهای بنیادی برای “زنده کردن” پیوندها، استفاده از اتوگرافتهای عروقسازیشده یا تثبیت نوین برای تقویت آنها، و حتی بررسی استخوانهای مهندسیشده بافتی و ایمپلنتهای چاپشده سهبعدی به عنوان جایگزینهای آینده. این یک زمان هیجانانگیز در زمینه انکولوژی اسکلتی عضلانی است، زیرا علم و مهندسی برای ایمنتر و مؤثرتر کردن بازسازیها همگرا میشوند.
به طور خلاصه، استفاده از استخوانهای آلوگرافت منجمد و تازه در استئوسارکوما از یک ایده آزمایشی به یک رویه تثبیتشده که با تجربه جهانی پشتیبانی میشود، تکامل یافته است. از اولین مورد ساده در سال ۱۸۷۹ تا تحقیقات پیشگامانه سال ۲۰۲۵، آلوگرافتها به طور مداوم سازگار و بهبود یافتهاند. جراحان و بیماران در سراسر جهان از این پیشرفت بهرهمند شدهاند؛ تبدیل سرطانهای کشنده به شرایط قابل زندگی با اندامهای سالم. با پیشروی ما، نوآوری مداوم و مطالعات بالینی دقیق اطمینان میدهد که بازسازیهای با آلوگرافت حتی قابل اعتمادتر خواهند شد و به بیماران کمک میکند تا نه تنها از استئوسارکوما نجات یابند، بلکه با زندگیهای کارا و بدون درد، رشد کنند.
محصولات استخوان منجمد ریجن
یکی از محصولات آلوگرافت شرکت فرآورده بافت ایرانیان با نام تجاری ریجن آلوگرافت (Regen Allograft)، تولید و ارائه استخوانهای منجمد پرتودهیشده (Gamma Irradiation) به بیماران دچار استئوسارکوما است. این محصول با بهرهگیری از فناوری پرتودهی گاما در دوز استاندارد، علاوه بر حفظ استحکام مکانیکی، ایمنی بالایی در برابر انتقال بیماریهای ویروسی و باکتریایی فراهم میکند. فرآیند تهیه شامل برداشت استریل بافت استخوانی از اهداکنندگان واجد شرایط، غربالگری دقیق از نظر بیماریهای عفونی، انجماد در دمای مفنی 80 درجه سانتی گراد و سپس استریلیزاسیون نهایی است.
آلوگرافتهای ریجن با حفظ ساختار کلاژنی و خواص زیستسازگاری، امکان ادغام مناسب با استخوان میزبان را فراهم کرده و بهعنوان داربستی برای بازسازی بافت استخوانی عمل میکنند. این محصولات برای بازسازی نقصهای بزرگ استخوانی پس از برداشت تومورهای بدخیم همچون استئوسارکوما، جایگزین مناسبی برای پروتزهای مصنوعی به شمار میآیند.
مزایای کلیدی ریجن آلوگرافت عبارتند از:
- ایمنی بالا بهواسطه پرتودهی و غربالگری دقیق اهداکننده
- قدرت مکانیکی قابلقبول برای تحمل بارهای اسکلتی در اندامها
- زیستسازگاری و هدایت استخوانی (Osteoconduction) بهمنظور تسهیل ترمیم و بازسازی بافت استخوانی
- امکان استفاده در بازسازیهای پیچیده شامل اندامهای بلند و مفاصل پس از برداشت تومور
برای کسب اطلاعات بیشتر و ثبت سفارش، وارد صفحه ثبت سفارش ثبت سفارش استخوانهای منجمد ریجن آلوگرافت شوید.
منابع مطالعاتی
- An orthopaedic conquest: the first inter-human tissue transplantation, Knee Surgery, Sports Traumatology, Arthroscopy (KSSTA), DOI: 10.1007/s00167-013-2669-7
- Bone allografts: past, present and future, Cell and Tissue Banking, DOI: 10.1023/A:1010158731885
- Fresh-frozen vs. irradiated allograft bone in orthopaedic reconstructive surgery, Injury, DOI: 10.1016/j.injury.2009.01.116
- Radiation sterilization of tissue allografts: A review, World Journal of Radiology (WJR, World J Radiol), DOI: 10.4329/wjr.v8.i4.355]
این مطلب چقدر مفید بود؟
برای امتیاز دادن، روی یک ستاره کلیک کنید!
میانگین امتیاز 5 / 5. تعداد امتیازها 4
شما اولین نفر باشید که امتیاز می دهید!
مطالب مرتبط



مشاوره رایگان
به مشاوره نیاز دارید؟
کادر حرفه ای و تخصصی شرکت فرآورده بافت ایرانیان آماده راهنمایی شما عزیزان می باشند